Digitales Labormanagement in ISO-zertifizierten Laboren
Die Einführung eines Qualitätsmanagementsystems ist für viele Laboratorien, die die gleichbleibende Qualität ihrer Produkte und Dienstleistungen sicherstellen möchten, ein wichtiger Schritt.
Digitales Labormanagement in ISO-zertifizierten Laboren
Die Einführung eines Qualitätsmanagementsystems ist für viele Laboratorien, die die gleichbleibende Qualität ihrer Produkte und Dienstleistungen sicherstellen möchten, ein wichtiger Schritt.
Digitales Labormanagement in ISO-zertifizierten Laboren
Die Einführung eines Qualitätsmanagementsystems ist für viele Laboratorien, die die gleichbleibende Qualität ihrer Produkte und Dienstleistungen sicherstellen möchten, ein wichtiger Schritt.
Digitales Labormanagement in ISO-zertifizierten Laboren
Die Einführung eines Qualitätsmanagementsystems ist für viele Laboratorien, die die gleichbleibende Qualität ihrer Produkte und Dienstleistungen sicherstellen möchten, ein wichtiger Schritt.
Download Whitepaper
ISO-Konformität
Die Einführung eines Qualitätsmanagementsystems ist für viele Laboratorien, die die gleichbleibende Qualität ihrer Produkte und Dienstleistungen sicherstellen möchten, ein wichtiger Schritt. Folglich ist die Zertifizierung von ISO-Normen für viele Laboratorien ein wesentlicher Bestandteil der Unternehmenskultur. Nach erfolgreichem Erhalt der Zertifizierung können Unternehmen ihren Kunden externe Nachweise für die Umsetzung der Qualitätsstandards vorlegen. In einigen Bereichen, beispielsweise in der Medizintechnik, ist die Zertifizierung sogar verpflichtend.
Softwarelösungen können dazu beitragen, den Aufwand und die Kosten für die Vorbereitung und Durchführung der Zertifizierung und die Arbeit in der zertifizierten Umgebung zu reduzieren. In diesem Whitepaper werden wir untersuchen, welche Prinzipien die wichtigsten ISO-Normen sind, die Laboratorien befolgen müssen, und welche Anforderungen sich auf Labormanagement und Dokumentation beziehen.
Eine kurze Liste mit Informationen darüber, warum ein Labor ISO-konform ist, und zu anderen Vorteilen der Verwendung eines ELN finden Sie hier.
Anhand von Praxisbeispielen aus dem Labfolder ELN können wir sehen, wie eine spezialisierte Softwarelösung die Vorbereitung, Durchführung und Durchführung einer Zertifizierung erleichtern kann.
*Wenn Sie die ISO-Konformitätsinformationen als Datei haben möchten, können Sie hier kostenlos auf die PDF-Version dieses Whitepapers zugreifen:
Für Laboratorien relevante Normen
ISO-Normen wurden von der Internationalen Organisation für Normung mit dem Ziel erstellt, international einheitliche und akzeptable Standards bereitzustellen. Für Laboratorien sind die folgenden Normen besonders relevant:
ISO 9001
Diese Norm ist ein allgemeiner Qualitätsmanagementstandard für Organisationen aus allen Verbänden und Bereichen und daher einer der Standards mit den meisten Zertifizierungen weltweit. ISO 9001 bildet auch die Grundlage für branchenspezifische Normen.
ISO 13485
(Hersteller medizinischer Geräte)
Die Umsetzung dieser Norm ist für Hersteller medizinischer Geräte aufgrund bestimmter Vorschriften vorgeschrieben. Auch wenn ISO 13485 eine separate Norm ist, basiert sie immer noch auf ISO 9001, enthält jedoch weitere Kriterien, die sich auf den jeweiligen Bereich beziehen.
ISO 15189
(Medizinische und diagnostische Labore)
Dieser Standard ist ebenfalls von ISO 9001 abgeleitet, auch wenn er unabhängig implementiert wird.
ISO 17025
(Prüf- und Kalibrierlabore)
Ähnlich wie die Normen ISO 13485 und 15189 ist diese Norm unabhängig und leitet sich von ISO 9001 ab.
Prinzipien und Implikationen von Qualitätsmanagementsystemen
Laborrelevante ISO-Normen folgen alle den gleichen Prinzipien, was bedeutet, dass sie zu harmonisierten Anforderungen für Organisationen führen, die die ISO-Normen umsetzen:
Prozessorientierter Ansatz
Qualitätsmanagementsysteme werden alle von Prozessen gesteuert. Daher sind Prozesse ein wesentlicher Bestandteil aller QM-Systeme gemäß den ISO-Standards festgelegter Prozesse, die mithilfe des PDCA-Zyklus (Plan, Do, Check, Act) implementiert werden. Die nachfolgenden Schritte werden befolgt und wiederholt:
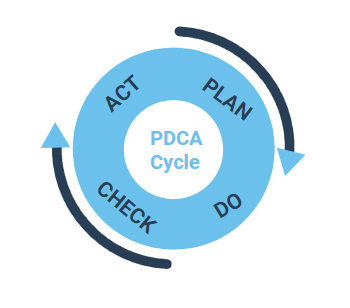
Planen: Prozesse werden geplant, indem die Situation analysiert, die Prozessanforderungen befolgt und über mögliche Verbesserungen entschieden wird.
Tun Sie: Prozesse werden in einer Testumgebung auf ihre Validität hin untersucht, d. h. wie effektiv sie die Anforderungen erfüllen.
Prüfen Sie: Die Ergebnisse der Validierung werden überprüft und der Prozess wird entweder genehmigt (nach erfolgreicher Validierung) oder weiter verbessert.
Handlung: Der validierte Prozess wird in größerem Umfang als Standardprozess definiert und allen Benutzern innerhalb der Organisation zur Verfügung gestellt.
Wenn Sie dem Prozessansatz folgen, müssen die Prozesse in allen Phasen des PDCA-Zyklus zusammen mit ihrem aktuellen Validierungsstatus dokumentiert werden.
Daher müssen digitale Labormanagementsysteme in ISO-zertifizierten Laboren in der Lage sein, Prozessbeschreibungen zu dokumentieren, die ihren Validierungsstatus betreffen. Im Zuge des Validierungsprozesses muss ein Lese- und/oder Schreibzugriff für verschiedene Personengruppen gewährleistet werden.
Menschenorientiert
Da Qualitätsmanagementsysteme die Effizienz der gesamten Organisation fördern, konzentrieren sich alle Mitglieder der Organisation auf QM-Systeme. Bei diesen muss sichergestellt werden, dass:
- Die Geschäftsleitung und alle Mitarbeiter verpflichten sich zum Qualitätsmanagement.
- Die verschiedenen Rollen mit unterschiedlichen Verantwortlichkeiten sind verteilt, z. B. wird die Führungsrolle zwischen dem zuständigen Laborleiter und dem QM-Beauftragten aufgeteilt.
- Die Dokumentation des QM-Systems wird allen Mitarbeitern je nach ihrer Rolle zur Verfügung gestellt.
- Prozesse, einschließlich der Prozessänderungen und der entsprechenden Dokumente, können nur von den entsprechenden, autorisierten und qualifizierten Mitarbeitern umgesetzt werden.
Daher können für digitale Labormanagementsysteme in ISO-zertifizierten Labors die Anforderungen, die Organisationsstruktur, die Rollen, Rechte und der Austausch von Dokumenten verwaltet werden.
ISO-Zertifizierung und Dokumentation
Voraussetzung für die Umsetzung von ISO-Normen in Laboratorien ist die Schaffung einer Infrastruktur. Darin können die Prozesse in Dokumenten beschrieben und der Validierungsstatus aufgezeichnet und geändert werden.
Schreibzugriff auf Dokumente in verschiedenen Validierungsphasen können nur Mitarbeitern gewährt werden, denen innerhalb der Organisationsstruktur die entsprechenden Rechte zugewiesen wurden (z. B. QM-Manager).
Das digitale Labormanagementsystem muss auch in der Lage sein, die Standardprozesse leicht zugänglich zu machen und sie mühelos in die bestehende Labordokumentation zu integrieren. Ein systemspezifisches Rechte- und Rollenmanagement stellt zudem sicher, dass nur autorisierte Mitarbeiter Zugriff auf die relevanten Standardvorschriften und -protokolle haben. Daher überschneiden sich die Anforderungen der klassischen Labordokumentation mit den Anforderungen an die Dokumentation in ISO-zertifizierten Laboren, insbesondere wenn ein einheitliches System ebenfalls den Aufwand deutlich reduziert.
Daher hat Labfolder Funktionen in sein digitales Labornotizbuch integriert, die die allgemeinen Anforderungen der klassischen Labordokumentation, die Anforderungen an die Dokumentation im Labor, die den ISO-Standards entspricht, und die Anforderungen der ISO-Normen auf einer einheitlichen Plattform erfüllen. Auf diese Weise kann eine beträchtliche Menge an Ressourcen eingespart werden, da Labfolder die Dokumentationsanforderungen ohne zusätzlichen Aufwand einhält.
Anforderungen und Funktionalitäten in der Dokumentation
(gemäß ISO-Standards)
In einer ISO-zertifizierten Umgebung müssen unabhängig vom Standard die folgenden Informationen und Dokumente aufbewahrt werden:
- Ein Qualitätshandbuch, in dem der Umfang des QM-Systems, die Vorschriften für die Prozessvalidierung und für das Dokumentenmanagement sowie die Definition der Rollen detailliert beschrieben wurden.
- Prozessvorschriften (Standard Operating Procedures, SOPs) im jeweiligen Validierungsstatus, einschließlich der entsprechenden autorisierenden Person.
- Validierte Materialien und Ausrüstung, einschließlich der autorisierenden Person.
- Daten aus den Prozessen, die für eine Prozessvalidierung oder -optimierung gesammelt werden können.
- Dokumentation von Abweichungen im Analyse- und Produktionsprozess.
- Die Organisationsstruktur, einschließlich der Verantwortlichkeiten der Mitarbeiter innerhalb des QM-Systems.
Die Anforderungen an diese Dokumente und ihre Pflege lauten in den ISO-Normen wie folgt:
Titel des Dokuments
Dokumente, Prüfergebnisse und Kalibrierungszertifikate müssen einen Titel haben.
Beispiel: In Labfolder kann jedem Dokument ein Titel zugewiesen werden, der in der Dokumentenübersicht angezeigt wird.
Datum des Dokuments, Datum der Änderung und Datum der Validierung/Ungültigerklärung
Für alle oben genannten Dokumente (Laboraufzeichnungen, SOPs, Validierungsprotokolle, Kalibrierungsprotokolle und für das Qualitätshandbuch) muss der Zeitpunkt der Erstellung, Änderung, Validierung und Ungültigerklärung aufgezeichnet werden.
Beispiel: Labfolder fügt jedem Dokument innerhalb der Plattform automatisch einen Zeitstempel hinzu. Die Zeitstempel zeichnen auf, wann das Dokument erstellt wurde und wann es das letzte Mal geändert wurde. Darüber hinaus können je nach Wunsch des Benutzers zusätzliche Zeitstempel hinzugefügt werden. Digitale Signaturen gemäß CFR 21 Part 11 sind ebenfalls mit einem Zeitstempel gekennzeichnet. Für jedes Dokument können alle Änderungen, einschließlich des Zeitstempels im vollständigen Audit-Trail des Dokuments, zur Rechenschaft gezogen werden.
Nummer des Dokuments
Alle Dokumente innerhalb des QM müssen eine eigene spezifische ID haben.
Beispiel: Labfolder weist allen Dokumenten eine eindeutige ID zu. Zusätzlich wird ein eindeutiger Code generiert, der aus dem entsprechenden Projekt und der Seriennummer besteht, und dem Dokument hinzugefügt.
Autorisierung des Zugriffs auf Dokumente
Versionen können nur von derselben autorisierten Person bearbeitet werden.
Innerhalb des Versionierungs- und Validierungszyklus eines Dokuments hat nur die Person, die im Rahmen des QM-Systems innerhalb der Organisationsstruktur Änderungen vorgenommen hat, das Recht, einen Eintrag zu ändern.
Beispiel: In Labfolder innerhalb der Freigabeeinstellungen (was z. B. einem Teil des Validierungsprozesses entspricht) können Dokumente nur von einem Autor bearbeitet werden, der die entsprechenden Rechte besitzt. Nach Abschluss der Bearbeitung kann das Dokument dann von anderen autorisierten Personen weitergegeben und bearbeitet werden.
Seitenzahlen
Dokumente auf Papier (z. B. Berichte usw.) müssen deutlich markierte Seitenzahlen haben, die sich auf die genaue Seite beziehen, einschließlich Abschnitten wie der Änderungshistorie.
Beispiel: Im digitalen Format von Labfolder sind die Seitenzahlen nicht unbedingt erforderlich. Beim Exportieren und Drucken von Dokumenten werden serielle Seitenzahlen jedoch automatisch hinzugefügt.
Autoren von Dokumenten
Dokumente müssen Informationen darüber enthalten, wer sie erstellt hat.
Beispiel: Labfolder fügt jedem Dokument automatisch Informationen über den Autor hinzu.
Verfügbarkeit
Dokumente müssen die Namen der autorisierten Personen zur Verfügung stellen.
Beispiel: Labfolder hat verschiedene Einstellungen für die gemeinsame Nutzung von Dokumenten, sodass die autorisierte Person sofort die Erlaubnis erhält, auf sie zuzugreifen. Das bedeutet, dass die Dokumente auch in Ordnern organisiert werden können, was das Teilen und Zugreifen auf immer größere Datenmengen erleichtert. Für SOPs, die sehr regelmäßig verwendet werden, gibt es in Labfolder einen eigenen Bereich, der das Teilen und Verwenden von SOPs erheblich erleichtert.
Vollständiger Audit-Trail
Alle an Dokumenten vorgenommenen Änderungen sollten sichtbar sein, einschließlich Informationen darüber, von wem und wann das Dokument geändert wurde.
Beispiel: Labfolder erstellt für jedes Dokument einen vollständigen Audit-Trail, der die Änderungen aufzeichnet, einschließlich Informationen zu Uhrzeit und Autor.
Entvalidierung des Dokuments
Ungültige Dokumente müssen gerendert und als ungültig markiert werden.
Beispiel: Labfolder ermöglicht das „Löschen unter Einschränkungen“, bei dem ungültige Dokumente wie SOPs markiert und nicht mehr verwendbar sind. Obwohl all diese Dokumente und Versionen als unbrauchbar markiert sind, existieren sie immer noch und können nicht dauerhaft gelöscht werden.
Dokumentenlisten
Alle Dokumente müssen in einer „Masterliste“ verwaltet werden.
Beispiel: Labfolder hat für alle Dokumentkategorien eine Schaltfläche „Archivieren“, in der die Einträge archiviert werden und einzelne Einträge auch wieder auftauchen können. In dieser Übersicht sind alle Gültigkeitsinformationen wie Validierungsstatus, Autoren, Daten usw. verfügbar.
Regelmäßige Überprüfung
Prozessvorschriften und SOPs müssen in regelmäßigen Abständen überarbeitet und aktualisiert werden.
Beispiel: Aufgrund der Zeitstempel auf jedem Dokument ist es einfach zu überprüfen, ob eine Überarbeitung fällig ist. Autorisierte Personen werden in einem Aufgabenverwaltungssystem in Labfolder auf das Datum der Überarbeitung hingewiesen.
Validierung der Laborverwaltungssoftware
(in zertifizierter Laborumgebung)
Eine Laborverwaltungssoftware wie Labfolder muss in einer ISO-zertifizierten Umgebung validiert werden, genau wie andere Materialien und Geräte, die auch im Labor verwendet werden. Im Rahmen der Softwarevalidierung werden keine neuen Funktionen entwickelt, stattdessen findet eine Überprüfung der Validierung statt. Im Rahmen dieses Validierungsprozesses werden die folgenden Phasen abgeschlossen:
Phase 1: Spezifikation der Anforderungen und der Systemtests
In dieser Phase wird die Software auf der Grundlage der Anforderungen in der Laborumgebung validiert. Damit wird auch festgelegt, welche Funktionen welche Aufgaben innerhalb der Organisation übernehmen werden. Die Ausführung dieser Sicherheitsmaßnahmen wird in dieser Phase ebenfalls validiert, ebenso wie bestimmte Softwareanforderungen. Auf der Grundlage dieser Analyse kritischer Pfade und Funktionen wird anschließend eine Risikobewertung durchgeführt. Am Ende der Phase 1 werden die Tests für die Zulassung und die Prozesse für die Wartung und Einstellung der Software spezifiziert.
Phase 2: Prozesse für Design und Implementierung
In dieser Phase wird das Design der Software im Hinblick auf die Anforderungen untersucht. Ein aktiver Entwicklungsprozess ist Teil der Validierung. Daher werden in dieser Phase entweder die Prozesse innerhalb der Entwicklungsfunktionen oder die technischen Details der Implementierung spezifiziert. In dieser Phase werden auch die Verfahren für eine Konstruktionsänderung als Korrekturmaßnahme spezifiziert.
Phase 3: Inspektion und Test
In dieser Phase wird ein Testplan im Rahmen der Kriterien erstellt, die für eine erfolgreiche Validierung festgelegt wurden. Nach der Validierung des Testplans werden die entsprechenden Tests durchgeführt.
Phase 4: Sicherheitsmaßnahmen
In dieser Phase werden Verfahren zur Erkennung und Dokumentation von Abweichungen innerhalb der Software spezifiziert. Sowohl für neu festgestellte als auch für bekannte Abweichungen werden Umgehungsmöglichkeiten angegeben.
Phase 5: Installation der Software
Im Rahmen der Installationsphase wird die Softwareinstallation vorbereitet, getestet und danach, je nach Testplan, validiert.
Phase 6: Leistungsmessung, Wartung und Schließung
In dieser Phase werden Verfahren zur kontinuierlichen Messung der Leistung und der Konformität mit der Software spezifiziert. In dieser Phase werden auch Prozesse etabliert, die für die Softwarepflege notwendig sind, was zur Softwareoptimierung beiträgt. Zusätzlich werden in dieser Phase Prozesse für das Upgrade sowie die Einstellung der Software implementiert, falls die Situation eintreten sollte.
Die Softwarevalidierung stellt sicher, dass die Software ihre Anforderungen ständig erfüllt und kontinuierlich konsistente Ergebnisse liefert.
Labfolder unterstützt die Validierung und Implementierung der Labormanagementsoftware mithilfe eines Validierungsprotokolls, mit dem Sie die Validierung einfach installieren und ausführen sowie Ergänzungen zum Qualitätshandbuch vornehmen können, während Sie gleichzeitig Ressourcen sparen.
In allen Phasen der Zertifizierung und kontinuierlichen Implementierung eines Qualitätsmanagementsystems gemäß ISO ist es möglich, Kosten und Aufwand durch den Einsatz von Labfolder, einer Spezialsoftware für das digitale Labormanagement, zu reduzieren.
Haben Sie weitere Fragen zum digitalen Labormanagement in ISO-zertifizierten Laboren? Nehmen Sie Kontakt mit uns auf! Unsere Experten helfen Ihnen jederzeit gerne persönlich weiter.
Read more
Discover the latest in lab operations, from sample management to AI innovations, designed to enhance efficiency and drive scientific breakthroughs.




